El flagelo bacteriano es una estructura muy compleja. Cierto. Es un motor molecular que necesita una interacción de más de 40 proteínas distintas.
Me podría poner ahora a explicar a fondo cuál es el funcionamiento general del flagelo bacteriano... pero me saldría del tema; lo que quiero explicar es cómo evolucionó.
Si quieres comprender el funcionamiento del flagelo bacteriano puedes leer esta entrada de la wikipedia, que he revisado y está bastante bien explicada.
Los creacionistas del diseño inteligente admiran la complejidad del flagelo de las bacterias. Dicen que esa complejidad nunca puede ser fruto de la casualidad, ya que funciona como un motor complejo, y si se elimina una sóla pieza deja de ser operativo. Y desde ahí, caen en las falacias habituales ya explicadas en el artículo de la primera parte, y a las cuales no voy a volver.
Por supuesto, el primero de los problemas en esa aserción es lo de que sea fruto de la casualidad. Como ya expliqué en mi vídeo «la falsa improbabilidad de la evolución», la evolución no es casual: es posible que haya factores que sean azarosos, como las mutaciones; sin embargo la selección natural no es azarosa de ningún modo, y por tanto la evolución per se tampoco lo es.
Y además, del mismo modo que sucedió con la entrada acerca del ojo, estamos ante un argumento sostenido sobre falsas premisas: realmente sí que conocemos los rudimentos del proceso evolutivo que dio lugar al flagelo bacteriano.
Es cierto que este motor molecular es una de las máquinas biológicas descubiertas más fascinantes. Cada uno de sus componentes se engrana con el resto de una forma perfectamente sincronizada y la eliminación de una sola de las proteínas produce ineludiblemente la pérdida de la funcionalidad del flagelo al completo.
¿Pero significa eso que no ha podido evolucionar? De ningún modo. Estamos olvidando un aspecto importante de la evolución biológica, que no solo no es raro que suceda sino que hemos observado un buen número de ocasiones: una estructura con una función puede terminar dando lugar otra estructura más compleja con otra función completamente distinta.
El ejemplo más sencillo en este caso es el de las plumas. Las escamas de los reptiles tiene una clara función protectora. Las plumas filamentosas, derivadas directas de estas escamas, pueden cumplir funciones nuevas como la sensitiva o la sexual —mediante el uso de colores brillantes—. Unas plumas más tupidas pueden adquirir una nueva función de mantenimiento de la temperatura corporal, y unas plumas de forma asimétrica pueden adquirir la nueva función para favorecer el vuelo y sus maniobras. Es decir, lo que hoy sirve a las aves para volar, tuvo muchas otras funciones diferentes antes. La evolución solo aprovechó una estructura preexistente (la pluma) y la modificó para formar funciones nuevas.
En resumen. No hace falta que un sistema tenga la misma función que tenía el sistema ancestral del cual procede.
Esto mismo es lo que sucedió con el flagelo.
El proceso comienza con la formación de un poro pasivo en la membrana interna de la bacteria. Estos poros pasivos permiten la libre comunicación entre el citoplasma y el periplasma —el espacio que hay entre la membrana interna y la pared celular—, y por tanto, el libre paso de proteínas de un lado a otro.
Una proteína asociada al poro por la cara citoplasmática permite que el paso de las proteínas del citoplasma al periplasma sea, aún pasivo, pero ahora selectivo: una ventaja evolutiva respecto al caso anterior.
La asociación de la Sintasa-ATP —un complejo proteico anterior al flagelo— permite al poro un transporte activo, lo que supone una ventaja respecto al transporte pasivo de la fase anterior. Este complejo es el ancestral del complejo de exportación de tipo III.
Las chaperonas y las secretinas son proteínas que, asociadas, comunican la pared celular con la membrana externa y que permiten el desplazamiento de las proteínas desde el periplasma hacia el exterior de la bacteria; estas proteínas pueden asociarse fácilmente al complejo de exportación, lo que termina formando una estructura aún más compleja que permite el paso activo de proteínas desde el interior citoplasmático hasta el exterior de la célula. Este complejo de secreción sería el ancestral del que conocemos como tipo III.
Gracias a este complejo proteico evolutivo que hemos denominado Complejo de Secreción de Tipo III, pueden transportarse proteínas adhesivas controladas a sustratos, que una vez secretadas por el complejo de secreción, se quedan fijas a la parte exterior del complejo. ¿Qué? ¿Que cómo se pueden pegar donde corresponde y no en otro sitio? Por la afinidad de sustratos, que es un sistema de afinidad químico que hace que cada pieza encaje donde corresponde como una llave encaja en su cerradura.
Mediante la excreción continua de estas proteínas, se va formando un tubo, que se denomina pilus que favorece la adherencia de la bacteria a un sustrato determinado. Aquella bacteria que tiene el pilus más largo tendrá más éxito en esta función, y por tanto será favorablemente seleccionada. Aquella que intente formar el pilus con las proteínas equivocadas (con llaves distintas que encajen en otro lugar de la proteína chaperona) no conseguirá formarlo, y por tanto será seleccionada de forma negativa.
Si además, esas proteínas atraviesan físicamente la membrana externa y se asocian hacia abajo hasta donde está el poro, se consigue una mayor fortaleza en el sistema, ya que permite que todo el complejo se fije a las dos membranas y a la pared celular. La estabilidad de este complejo es ahora mucho mayor, y por ende, su portador es mucho más apto. La flexibilidad del pilus es también importante. Unas proteínas que permitan al tubo ser flexible favorecen a la bacteria al incrementar sus capacidades a la hora de encontrar sustratos.
Otro sistema proteico interesante es el Tol-Pal. Éste se encarga de transformar el paso de los protones a través de las membranas en movimiento. La asociación del sistema Tol-Pal con el pilus produciría un movimiento de giro leve. Esto supone una ventaja, pues favorece la movilidad del plus y por tanto, incrementa más aún la capacidad de encontrar nuevos sustratos por parte de la bacteria. Además, un movimiento activo permite a la bacteria moverse o quedarse quieta a voluntad —por efecto de acción-reacción—, lo que favorece que la bacteria pueda huir de aquellos ambientes que tengan pocos nutrientes. Es un ejemplo de un cambio leve que provoca una ventaja muy fuerte.
Una modificación en forma de reducción de la proteína secretina hace que se pierda el contacto entre la membrana externa y el pilus. Se forma, como efecto secundario, un anillo que denominamos anillo-P. La chaperona se modifica, entonces, en un nuevo anillo, que denominamos anillo-F, que refuerza el orificio de la membrana externa, incrementando así la estabilidad del complejo. Estos dos anillos estabilizan el filamento, permitiéndole rotar con mucha mayor libertad.
Las proteínas de transición de señales se asocian a este protoflagelo, haciéndolo quimiotáctico, es decir, sensible a las posibles señales químicas que la bacteria pueda lanzar. Esto genera también un avance importante: la bacteria ahora puede mover el flagelo «a voluntad».
Me he ahorrado los nombres de las proteínas y sus homólogas en fases intermedias observadas, por simplicidad y mejora de la comprensión del proceso. Cualquiera que esté interesado en los detalles de los pormenores, puede leer éste y otros artículos científicos al respecto. Si quieres más, no dudes en preguntar.
Lo que podemos claramente observar es que cada pequeño paso en el proceso evolutivo aporta un nuevo producto perfectamente funcional y que aporta a la bacteria portadora una importante ventaja evolutiva.
Leer más...
 |
| Esquema del motor bacteriano. Fuente (sí, es una página creacionista) |
Si quieres comprender el funcionamiento del flagelo bacteriano puedes leer esta entrada de la wikipedia, que he revisado y está bastante bien explicada.
Los creacionistas del diseño inteligente admiran la complejidad del flagelo de las bacterias. Dicen que esa complejidad nunca puede ser fruto de la casualidad, ya que funciona como un motor complejo, y si se elimina una sóla pieza deja de ser operativo. Y desde ahí, caen en las falacias habituales ya explicadas en el artículo de la primera parte, y a las cuales no voy a volver.
Por supuesto, el primero de los problemas en esa aserción es lo de que sea fruto de la casualidad. Como ya expliqué en mi vídeo «la falsa improbabilidad de la evolución», la evolución no es casual: es posible que haya factores que sean azarosos, como las mutaciones; sin embargo la selección natural no es azarosa de ningún modo, y por tanto la evolución per se tampoco lo es.
Y además, del mismo modo que sucedió con la entrada acerca del ojo, estamos ante un argumento sostenido sobre falsas premisas: realmente sí que conocemos los rudimentos del proceso evolutivo que dio lugar al flagelo bacteriano.
Es cierto que este motor molecular es una de las máquinas biológicas descubiertas más fascinantes. Cada uno de sus componentes se engrana con el resto de una forma perfectamente sincronizada y la eliminación de una sola de las proteínas produce ineludiblemente la pérdida de la funcionalidad del flagelo al completo.
¿Pero significa eso que no ha podido evolucionar? De ningún modo. Estamos olvidando un aspecto importante de la evolución biológica, que no solo no es raro que suceda sino que hemos observado un buen número de ocasiones: una estructura con una función puede terminar dando lugar otra estructura más compleja con otra función completamente distinta.
El ejemplo más sencillo en este caso es el de las plumas. Las escamas de los reptiles tiene una clara función protectora. Las plumas filamentosas, derivadas directas de estas escamas, pueden cumplir funciones nuevas como la sensitiva o la sexual —mediante el uso de colores brillantes—. Unas plumas más tupidas pueden adquirir una nueva función de mantenimiento de la temperatura corporal, y unas plumas de forma asimétrica pueden adquirir la nueva función para favorecer el vuelo y sus maniobras. Es decir, lo que hoy sirve a las aves para volar, tuvo muchas otras funciones diferentes antes. La evolución solo aprovechó una estructura preexistente (la pluma) y la modificó para formar funciones nuevas.
En resumen. No hace falta que un sistema tenga la misma función que tenía el sistema ancestral del cual procede.
Esto mismo es lo que sucedió con el flagelo.
1. El Complejo de Secreción tipo III
 |
| Complejo de Secreción Tipo III. Fuente |
El proceso comienza con la formación de un poro pasivo en la membrana interna de la bacteria. Estos poros pasivos permiten la libre comunicación entre el citoplasma y el periplasma —el espacio que hay entre la membrana interna y la pared celular—, y por tanto, el libre paso de proteínas de un lado a otro.
Una proteína asociada al poro por la cara citoplasmática permite que el paso de las proteínas del citoplasma al periplasma sea, aún pasivo, pero ahora selectivo: una ventaja evolutiva respecto al caso anterior.
La asociación de la Sintasa-ATP —un complejo proteico anterior al flagelo— permite al poro un transporte activo, lo que supone una ventaja respecto al transporte pasivo de la fase anterior. Este complejo es el ancestral del complejo de exportación de tipo III.
Las chaperonas y las secretinas son proteínas que, asociadas, comunican la pared celular con la membrana externa y que permiten el desplazamiento de las proteínas desde el periplasma hacia el exterior de la bacteria; estas proteínas pueden asociarse fácilmente al complejo de exportación, lo que termina formando una estructura aún más compleja que permite el paso activo de proteínas desde el interior citoplasmático hasta el exterior de la célula. Este complejo de secreción sería el ancestral del que conocemos como tipo III.
2. Formación del Pilus.
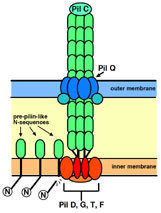 |
| Pilus bacteriano. Fuente. |
Gracias a este complejo proteico evolutivo que hemos denominado Complejo de Secreción de Tipo III, pueden transportarse proteínas adhesivas controladas a sustratos, que una vez secretadas por el complejo de secreción, se quedan fijas a la parte exterior del complejo. ¿Qué? ¿Que cómo se pueden pegar donde corresponde y no en otro sitio? Por la afinidad de sustratos, que es un sistema de afinidad químico que hace que cada pieza encaje donde corresponde como una llave encaja en su cerradura.
Mediante la excreción continua de estas proteínas, se va formando un tubo, que se denomina pilus que favorece la adherencia de la bacteria a un sustrato determinado. Aquella bacteria que tiene el pilus más largo tendrá más éxito en esta función, y por tanto será favorablemente seleccionada. Aquella que intente formar el pilus con las proteínas equivocadas (con llaves distintas que encajen en otro lugar de la proteína chaperona) no conseguirá formarlo, y por tanto será seleccionada de forma negativa.
Si además, esas proteínas atraviesan físicamente la membrana externa y se asocian hacia abajo hasta donde está el poro, se consigue una mayor fortaleza en el sistema, ya que permite que todo el complejo se fije a las dos membranas y a la pared celular. La estabilidad de este complejo es ahora mucho mayor, y por ende, su portador es mucho más apto. La flexibilidad del pilus es también importante. Unas proteínas que permitan al tubo ser flexible favorecen a la bacteria al incrementar sus capacidades a la hora de encontrar sustratos.
3. A por el flagelo
Otro sistema proteico interesante es el Tol-Pal. Éste se encarga de transformar el paso de los protones a través de las membranas en movimiento. La asociación del sistema Tol-Pal con el pilus produciría un movimiento de giro leve. Esto supone una ventaja, pues favorece la movilidad del plus y por tanto, incrementa más aún la capacidad de encontrar nuevos sustratos por parte de la bacteria. Además, un movimiento activo permite a la bacteria moverse o quedarse quieta a voluntad —por efecto de acción-reacción—, lo que favorece que la bacteria pueda huir de aquellos ambientes que tengan pocos nutrientes. Es un ejemplo de un cambio leve que provoca una ventaja muy fuerte.
Una modificación en forma de reducción de la proteína secretina hace que se pierda el contacto entre la membrana externa y el pilus. Se forma, como efecto secundario, un anillo que denominamos anillo-P. La chaperona se modifica, entonces, en un nuevo anillo, que denominamos anillo-F, que refuerza el orificio de la membrana externa, incrementando así la estabilidad del complejo. Estos dos anillos estabilizan el filamento, permitiéndole rotar con mucha mayor libertad.
Las proteínas de transición de señales se asocian a este protoflagelo, haciéndolo quimiotáctico, es decir, sensible a las posibles señales químicas que la bacteria pueda lanzar. Esto genera también un avance importante: la bacteria ahora puede mover el flagelo «a voluntad».
Me he ahorrado los nombres de las proteínas y sus homólogas en fases intermedias observadas, por simplicidad y mejora de la comprensión del proceso. Cualquiera que esté interesado en los detalles de los pormenores, puede leer éste y otros artículos científicos al respecto. Si quieres más, no dudes en preguntar.
Lo que podemos claramente observar es que cada pequeño paso en el proceso evolutivo aporta un nuevo producto perfectamente funcional y que aporta a la bacteria portadora una importante ventaja evolutiva.